En la comedia de 1992 "La muerte le sienta bien", protagonizada por Meryl Streep y Goldie Hawn, el miedo a envejecer lleva a las dos protagonistas a firmar un pacto con el diablo y beber una poción que detiene el envejecimiento y les devuelve una apariencia juvenil. En el mundo real, este mismo deseo ha dado lugar a innumerables procedimientos cosméticos que nos permiten engañar un poco al destino y escapar de nuestra edad verdadera.
De vez en cuando, conocemos a un hombre o una mujer que aparenta menos años. Muchos no pueden explicar por qué, y cuando reciben un cumplido, suelen responder con la misma frase conocida: "son los buenos genes".
Al mismo tiempo, hay personas que aparentan más edad de la que tienen. Podríamos pensar que están envejeciendo mal, y en este caso también podrían achacarlo a la genética o a las dificultades que han padecido.
En los últimos años, los científicos han desarrollado herramientas para estimar con mayor precisión nuestra edad biológica (el ritmo real de envejecimiento del cuerpo) en comparación con nuestra edad cronológica. Las investigaciones demuestran que pueden surgir diferencias significativas entre ambas, para bien o para mal.
Cómo cambian nuestras células
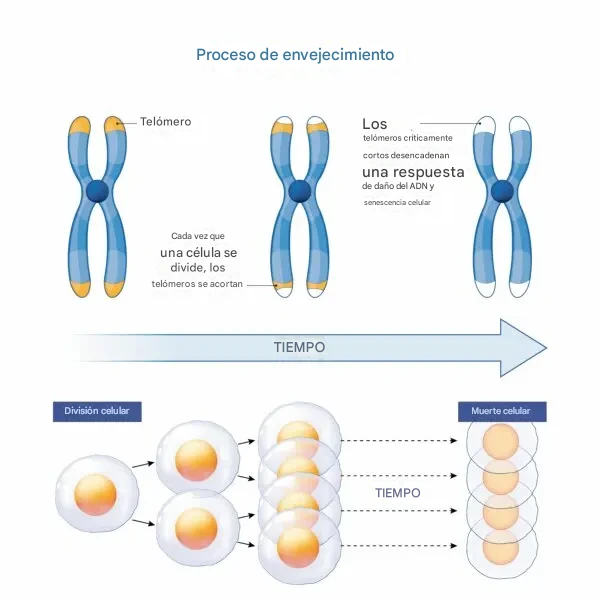
Para comprender qué nos hace envejecer o mantenernos relativamente jóvenes para nuestra edad, primero debemos poder medir nuestra edad biológica. Uno de los primeros métodos para hacerlo, identificado hace unos 30 años, relaciona el envejecimiento con los extremos de nuestros cromosomas, conocidos como "telómeros".Los cromosomas son 46 estructuras largas y filamentosas que se encuentran en los núcleos de nuestras células y que contienen toda la información genética que hemos heredado de nuestros padres.
En la década de 1970, Elizabeth Blackburn, durante su investigación postdoctoral en la Universidad de Yale, examinó los cromosomas en organismos unicelulares y descubrió algo fascinante: en los extremos de todos los cromosomas existe una larga cadena de secuencias repetitivas que no codifican nada relevante: el telómero.
Posteriormente se hizo evidente que estas estructuras repetitivas aparecen en los extremos de todos los cromosomas de todas las especies. En organismos más complejos, como los humanos, estas secuencias aparentemente sin sentido pueden repetirse miles de veces, formando telómeros muy largos.
En otro estudio realizado en la Universidad de California, Berkeley, en 1985, Blackburn y su estudiante de doctorado Carol Greider identificaron, en ciertas células, una enzima capaz de alargar los telómeros. La llamaron "telomerasa". En ese momento, Blackburn aún no entendía para qué servía este complejo mecanismo telómero ni por qué se alargaban.
Tras completar su doctorado, Greider continuó su investigación y, en 1990, resolvió el misterio. Tras recolectar fibroblastos (células del tejido conectivo de la piel) de donantes humanos de diferentes edades y medir la longitud de sus telómeros, Greider y sus colegas se sorprendieron al descubrir que, a mayor edad del donante, más cortos eran los telómeros. Además, al permitir que estas células siguieran dividiéndose en el laboratorio —un proceso que también ocurre en nuestro cuerpo a medida que envejecemos—, descubrieron que los telómeros se acortaban aún más con cada división celular.
A partir de esto, Greider concluyó que los telómeros protegen la información genética distribuida entre los cromosomas. Cada vez que una célula se divide en dos células hijas, se copian sus cromosomas y son los telómeros los que se acortan, no la información genética esencial, de esta manera, se previene el daño a genes con importancia hereditaria. En un artículo de 1990 , Greider explica que este no es el final de la historia: cuando un telómero se acorta demasiado, la célula ya no puede replicar sus cromosomas ni renovarse; en ese momento, muere.
 Cuando un telómero se acorta demasiado, una célula ya no puede replicar sus cromosomas ni renovarse; en ese momento, muere. (Shutterstock)
Cuando un telómero se acorta demasiado, una célula ya no puede replicar sus cromosomas ni renovarse; en ese momento, muere. (Shutterstock)En 2009, los profesores Blackburn y Greider, junto con un tercer investigador, Jack Szostak, recibieron el Premio Nobel de Fisiología o Medicina por sus descubrimientos sobre los telómeros. Como resultado, durante los últimos 20 años, los científicos han medido el ritmo del envejecimiento celular, o nuestro envejecimiento biológico, examinando la longitud de los telómeros. Cuanto más cortos son los telómeros, menor es nuestra esperanza de vida.
Sin embargo, en la última década, se han identificado varias limitaciones de esta técnica y se ha desarrollado una herramienta más precisa para evaluar el envejecimiento celular. Esta también está vinculada a los cromosomas, pero más a otros procesos que ocurren con el tiempo.
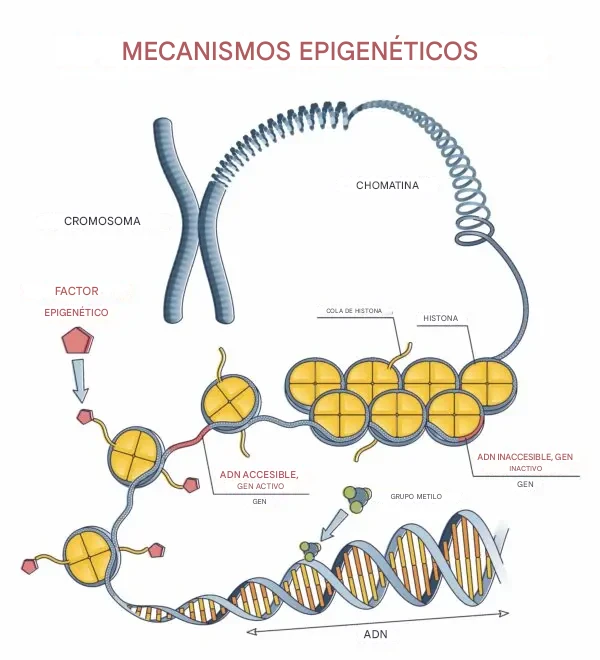
Las modificaciones químicas del ADN se denominan cambios epigenéticos. La información epigenética regula la actividad genética al controlar qué genes se expresan y cuáles se silencian. Por ejemplo, genes esenciales únicamente para la función hepática se silencian en las células de los ojos. En las últimas décadas, se ha comprobado que con el paso del tiempo se acumula información adicional en nuestros cromosomas y que estas alteraciones epigenéticas son uno de los motores principales del envejecimiento.
En 1975, el biólogo Arthur Riggs identificó un mecanismo central en los procesos de silenciamiento génico y lo llamó "metilación»". Desde entonces, se han descubierto otros mecanismos epigenéticos, pero la metilación sigue considerándose uno de los más importantes.
Un estudio publicado en 2005 por un grupo de investigación internacional liderado por científicos españoles demostró una fuerte conexión entre los procesos de metilación y el envejecimiento celular. El estudio incluyó a 40 pares de gemelos idénticos de entre 3 y 74 años. Los investigadores recolectaron linfocitos, un tipo de glóbulos blancos, de los participantes. Al examinar los cromosomas de las células y comparar los marcadores de metilación entre gemelos idénticos, observaron una clara tendencia: cuando los gemelos eran jóvenes, los patrones de metilación a lo largo de sus cromosomas eran similares o aparecían principalmente en los mismos lugares, lo que indicaba que los mismos genes estaban silenciados.
Construyendo relojes del envejecimiento
En ese momento, entra en escena el profesor Steve Horvath, de la Universidad de California en Los Ángeles. Horvath, quien durante su adolescencia en Alemania se sintió intrigado por la posibilidad de prolongar la vida humana, completó su doctorado en matemáticas en la Universidad de Carolina del Norte, Chapel Hill, en 1995, y un doctorado en bioestadística en Harvard en el año 2000. Consideró que podría ser capaz de comprender mejor los procesos de envejecimiento celular rastreando los patrones de metilación en los cromosomas."Me topé con el primer 'reloj epigenético' por casualidad", dijo Horvath en una charla TED de 2020. "Un colega me dio un conjunto de datos de metilación de saliva porque le interesaba estudiar la orientación sexual, pero estos datos no indicaron ninguna señal al respecto. Sin embargo, al correlacionar los datos de metilación con la edad, casi me caigo de la silla, debido a la intensidad de la señal".
Dijo que "inmediatamente decidí que dejaría todo lo demás en mi laboratorio y me concentraría en usar datos de metilación para construir 'relojes de envejecimiento'".
Horvath y sus colegas de la UCLA recolectaron muestras de saliva de 68 participantes (34 pares de gemelos idénticos de entre 21 y 55 años) y compararon sus datos de metilación. Sus hallazgos se publicaron en junio de 2011. Tras examinar unas 27,000 localizaciones genómicas, identificaron 88 sitios específicos donde la metilación se ve influenciada por la edad. En 69 de estos sitios, la metilación aumentó con la edad, lo que indica que los genes que habían estado activos en células más jóvenes se silenciaron en la vejez; en los otros 19 sitios, la metilación que había estado presente se eliminó, lo que indica que los genes considerados no esenciales en células específicas comenzaron a expresarse. Cuanto más se producen estas alteraciones en la metilación cromosómica, más se deteriora la función celular. El envejecimiento celular es una manifestación de dicho deterioro.
 En 69 de esos sitios, la metilación aumentó con la edad, lo que indica que los genes que habían estado activos en células más jóvenes se silenciaron en la vejez. (Shutterstock).
En 69 de esos sitios, la metilación aumentó con la edad, lo que indica que los genes que habían estado activos en células más jóvenes se silenciaron en la vejez. (Shutterstock).Al analizar la metilación en esos 88 sitios, Horvath desarrolló el primer "reloj epigenético", capaz de estimar la edad de un participante con un error absoluto medio de 5.2 años.
En otras palabras, una prueba de metilación realizada, por ejemplo, en sus células sanguíneas por alguien que nunca lo ha conocido, puede determinar su edad dentro de un rango de cinco años.
Sin embargo, cada tipo de tejido tiene sus propios patrones de metilación, dependiendo de las proteínas requeridas en ese tipo de célula. Esto llevó a Horvath a otra idea: desarrollar un reloj epigenético aplicable a todos los tejidos y tipos de células humanas, incluyendo muestras de sangre o células cerebrales de donantes fallecidos.
"Así es como desarrollamos el 'reloj pan-tejido'. Me das una muestra de ADN de cualquier célula de tu cuerpo y te diré tu edad", explicó Horvath en la misma charla TED, añadiendo que un objetivo más ambicioso era un 'reloj universal para mamíferos' que se aplicara a todas las especies de mamíferos. En agosto de 2023, en un artículo conjunto con decenas de investigadores de todo el mundo, Horvath y sus colegas propusieron un reloj epigenético de este tipo, adecuado para 185 especies diferentes de mamíferos.
Desde que se desarrolló el primer reloj de Horvath, otros investigadores han desarrollado una variedad de otros relojes epigenéticos y muchos alcanzaron una precisión aún mayor, uno de ellos llegando a un margen de error de 2.3 años.
Factores que afectan la rapidez con la que envejecemos
Un entorno verde, tranquilo y confortable
En un estudio publicado en diciembre de 2023, investigadores de Estados Unidos y Canadá examinaron cómo el vecindario en el que vivimos, en particular la extensión de los espacios verdes que contiene, afecta el acortamiento de nuestros telómeros y, en consecuencia, nuestro verdadero ritmo de envejecimiento.Los investigadores utilizaron la base de datos de la Encuesta Nacional de Examen de Salud y Nutrición y analizaron datos de aproximadamente 7800 participantes a lo largo de unos 20 años. Los datos incluían los lugares de residencia de los participantes e información sobre la disponibilidad de espacios verdes. Las muestras de sangre permitieron a los investigadores medir la longitud de los telómeros en los glóbulos blancos de los participantes y rastrear su evolución con el tiempo.
En un análisis inicial, los investigadores encontraron una clara asociación entre el entorno vital y la longitud de los telómeros. Concluyeron que vivir en un barrio con abundantes espacios verdes podría reducir nuestra edad biológica hasta 2.6 años respecto a nuestra edad cronológica.
 Los espacios verdes influyen en la velocidad del envejecimiento celular. (Christopher Furlong/Getty Images)
Los espacios verdes influyen en la velocidad del envejecimiento celular. (Christopher Furlong/Getty Images)Estrés crónico
El impacto del estrés crónico en el envejecimiento celular se conoce desde 2004, cuando Blackburn, junto con la psicóloga Elissa Epel, examinó la relación entre la experiencia individual de estrés crónico y el ritmo de acortamiento de los telómeros. Reclutaron a 39 madres que cuidaban a niños con enfermedades crónicas, una situación que implica estrés constante. El grupo de control incluyó a 19 madres de edades similares cuyos hijos estaban sanos. Los análisis de sangre permitieron a los investigadores medir la longitud de los telómeros en los glóbulos blancos de las madres. Los cuestionarios ayudaron a estimar el nivel de estrés que experimentaban.Los investigadores descubrieron que cuanto más estrés experimentaba una madre en su vida diaria, más cortos eran sus telómeros. Los cuestionarios mostraron que las madres que cuidaban a un niño con una enfermedad crónica experimentaban un estrés mucho mayor que las que tenían hijos sanos. Entre todas las madres menores de 50 años, los investigadores identificaron una diferencia de casi una década en la edad celular entre los grupos experimental y de control. Dentro del grupo con estrés crónico, cuanto más prolongado era el estrés (es decir, más años habían transcurrido desde el diagnóstico del niño), más cortos eran los telómeros de la madre.
En una entrevista que esta autora realizó a Epel en 2017, describió varios patrones de pensamiento que pueden aumentar el estrés diario y, por lo tanto, contribuir al acortamiento de los telómeros, incluidos los pensamientos pesimistas, la supresión del pensamiento, la rumia repetitiva sobre los problemas y más.
En otras palabras, nuestra percepción de las dificultades que enfrentamos puede desempeñar un papel fundamental en nuestro envejecimiento celular. Los investigadores observaron diferencias en la longitud de los telómeros entre las madres de niños enfermos que percibían los desafíos cotidianos como una amenaza y aquellas que los enfrentaban como obstáculos que podían superar. "Lo que determina el nivel de estrés de estas madres no es la complejidad del cuidado en sí, sino principalmente cómo reaccionan mentalmente ante la situación. La situación se percibe de forma diferente en sus pensamientos, y también hablan de ella de maneras distintas", explicó Epel.
Los relojes epigenéticos apuntan a tendencias similares en cuanto al estrés y el envejecimiento celular. En un estudio de 2021 , investigadores de la Universidad de Yale reclutaron a 444 personas sanas de entre 18 y 50 años y utilizaron entrevistas y cuestionarios para conocer los eventos estresantes que habían vivido antes del estudio. También evaluaron la capacidad de autocontrol y regulación emocional de los participantes. Los análisis de sangre ayudaron a determinar su edad biológica.
También en este caso el patrón era claro: cuanto mayor era el estrés acumulado que una persona había experimentado a lo largo de su vida, más se aceleraba su edad biológica en comparación con su edad cronológica.
 Vladimir/Shutterstock
Vladimir/ShutterstockActividad física
Tendemos a pensar que cuanto más ejercicio hacemos, más sanos —y quizás más jóvenes— estaremos. De hecho, estudios sobre la longitud de los telómeros y estudios basados en relojes epigenéticos han descubierto que la actividad física ayuda a que las células envejezcan más lentamente. Sin embargo, un equipo de investigación de la Universidad de Maryland concluyó en 2008 que la dosis de ejercicio es muy importante.El estudio de Maryland incluyó a 69 participantes sanos de entre 50 y 70 años, quienes informaron en entrevistas sobre sus actividades físicas semanales, incluyendo los ejercicios que hacían, la intensidad de las actividades, la frecuencia con la que se ejercitaban y la duración. Luego, los investigadores calcularon el gasto energético del ejercicio de cada participante, una medida de cuánta energía gasta una persona a través de la actividad física por semana. Para el análisis estadístico, los participantes se dividieron en cuatro grupos según su gasto energético del ejercicio. El grupo uno incluyó a aquellos que casi no hacían ejercicio (0–990 kcal/semana); el grupo dos incluyó a aquellos con actividad moderada (991–2340 kcal/semana); el grupo tres incluyó a aquellos con actividad alta (2341–3540 kcal/semana); el grupo cuatro incluyó a aquellos con los niveles de actividad más altos (por encima de 3540 kcal/semana).
Al examinar la longitud de los telómeros y la actividad de la telomerasa (la enzima que alarga los telómeros), los mejores resultados se obtuvieron en los dos grupos intermedios. Quienes pertenecían al grupo de mayor actividad envejecieron más rápido, con telómeros más cortos y menor actividad de la telomerasa, en comparación con los grupos de actividad moderada y alta.
También existen actividades físicas que, a pesar de ser tranquilas y requerir poco esfuerzo físico, ayudan a nuestras células a mantenerse jóvenes. En 2012, un grupo de investigación australiano examinó los efectos del tai chi —una suave práctica china que combina mente y cuerpo con movimientos lentos y fluidos— en mujeres mayores de 45 años. El grupo experimental incluyó a unas 240 mujeres de entre 45 y 88 años que habían practicado tai chi durante al menos tres años; el grupo de control incluyó a unas 260 mujeres de edades similares que nunca habían practicado tai chi.
Nutrición
Investigadores en Nápoles, Italia, examinaron cómo la dieta mediterránea afecta el envejecimiento celular. Esta dieta es conocida desde hace tiempo por sus beneficios para la salud y se caracteriza por un alto consumo de verduras, frutas, legumbres y pescado, junto con un consumo moderado de carne roja y lácteos. Se utilizaron entrevistas y cuestionarios para evaluar el estado de salud y los hábitos alimenticios de los participantes, quienes se dividieron en tres grupos según su nivel de adherencia a la dieta mediterránea. El estudio incluyó a 217 participantes de 71 años o más.Al examinar la longitud de los telómeros y la actividad de la telomerasa en los glóbulos blancos de los participantes, los investigadores observaron mejores resultados en el grupo de adherencia media que en el de adherencia baja. Sin embargo, los participantes con adherencia fuerte presentaron telómeros significativamente más largos y una mayor actividad de la telomerasa.
 La dieta mediterránea es conocida por sus beneficios para la salud. (Tatjana Baibakova/Shutterstock).
La dieta mediterránea es conocida por sus beneficios para la salud. (Tatjana Baibakova/Shutterstock).Pero no solo importa la calidad de los alimentos, sino también la cantidad. Los relojes epigenéticos sugieren que la restricción calórica también puede afectar el ritmo del envejecimiento celular. Investigadores de la Universidad de Texas examinaron los cambios de metilación en diversos tejidos (como el hígado, el bazo y la médula ósea) en ratones que, durante la mayor parte de su vida, consumieron una dieta con un 40 % menos de calorías que los ratones alimentados sin restricción. Descubrieron que la reducción de los cambios de metilación en el hígado y la sangre fue sustancial, con células medidas aproximadamente 1.6 años más jóvenes que la edad cronológica de los ratones. Se observó una reducción menor relacionada con la edad, de unos 0.4 años, en el intestino.
Consumo de cannabis
Investigadores en Estados Unidos examinaron los efectos del consumo de cannabis a largo plazo utilizando datos del estudio CARDIA (Desarrollo del Riesgo de Arteria Coronaria en Adultos Jóvenes), que ha dado seguimiento a unos 5000 estadounidenses desde mediados de la década de 1980. Los investigadores se centraron principalmente en unas 1900 personas que reportaron haber consumido marihuana a lo largo de los años. En unas 1000 de ellas, se midió la metilación después de 15 años de consumo de la droga; en otras, después de unos 20 años.Los investigadores identificaron alrededor de 200 sitios genómicos asociados con cambios de metilación relacionados con el consumo de marihuana, algunos relacionados con el consumo a largo plazo y otros con el consumo más reciente. Concluyeron que los numerosos cambios epigenéticos surgidos como resultado del consumo de cannabis podrían contribuir a diversas enfermedades, sin abordar específicamente el envejecimiento.
En otro estudio, un equipo internacional de investigadores realizó un seguimiento de 1037 residentes de Dunedin, Nueva Zelanda, de 18 a 45 años y recopiló datos sobre su consumo de cannabis, cigarrillos y alcohol. Al cumplir los 45 años, los investigadores calcularon el envejecimiento de sus cuerpos, no mediante relojes epigenéticos, sino mediante medidas como el envejecimiento cerebral (evaluado mediante resonancias magnéticas), la velocidad al caminar y la tasa de envejecimiento facial.
En busca del elixir
Tras desarrollar relojes epigenéticos y mejorar su precisión una y otra vez, Horvath continuó pensando en el futuro. Un estilo de vida saludable nos ayudará a envejecer más lentamente, afirmó en la charla TED. "Sin embargo, lamentablemente, no será suficiente con que llegues a los 123... Lo que necesitamos son intervenciones contra el envejecimiento mucho más eficaces"."¿Podemos utilizar estos relojes epigenéticos para identificar o validar intervenciones antienvejecimiento?”, preguntó.
Como resultado, en los últimos años, grupos de investigación de todo el mundo, incluido el de Horvath, han utilizado estas nuevas herramientas en la búsqueda continua de una misteriosa fórmula de la juventud que podría prolongar nuestra vida. En 2021, por ejemplo, investigadores de Estados Unidos y Canadá diseñaron un amplio experimento que abarcaba múltiples aspectos del estilo de vida. Los 43 participantes del grupo experimental, de entre 50 y 72 años, tuvieron que seguir durante ocho semanas un régimen estricto: una dieta principalmente vegetal con carne magra y suplementos probióticos.
También se pidió a los participantes que durmieran siete horas cada noche y mantuvieran un programa de cinco entrenamientos semanales de 30 minutos cada uno. Además, realizaron dos ejercicios de respiración diarios para reducir el estrés. Al final del experimento, se estimó que las células de los 18 participantes eran, en promedio, 1.96 años más jóvenes que aproximadamente una semana antes del régimen estricto. Sin embargo, dado que el experimento solo duró ocho semanas, no logró determinar cómo afectaría el régimen a la edad biológica a largo plazo de los participantes.
En un estudio clínico publicado en 2019, Horvath y sus colegas examinaron qué sucedería al estimular la producción de nuevas células en nuestro cuerpo. Utilizaron la hormona del crecimiento para restaurar la función del timo, un órgano clave en la producción de células del sistema inmunológico. Tras un tratamiento de un año con 10 participantes de entre 51 y 65 años, se calculó que la edad biológica de las células inmunitarias era 2.5 años menor que la que habrían tenido sin dicho tratamiento.
Aún queda un largo camino por recorrer antes de que se pueda encontrar un "elixir de la juventud" como el que Horvath imagina, si es que se puede encontrar. Mientras tanto, hay muchas cosas en nuestra vida diaria que, practicadas con constancia, pueden ayudarnos a mantenernos un poco más jóvenes y con más energía en relación con nuestra edad.














